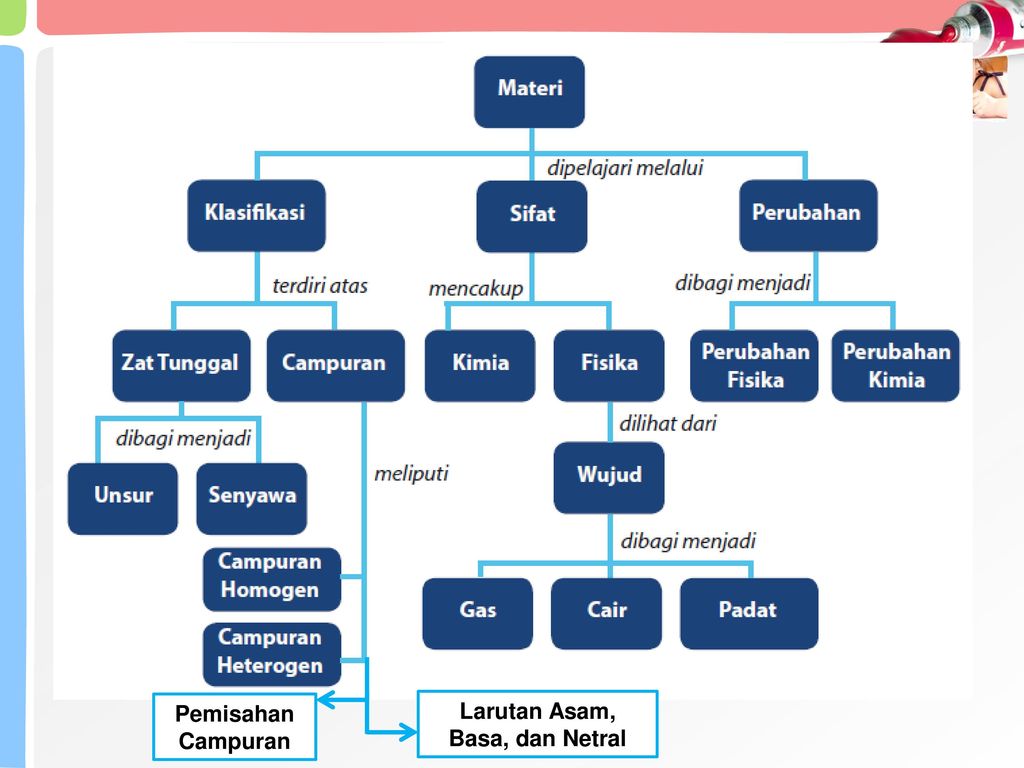
1. Pengertian Materi/Zat
Materi adalah segala sesuatu yang menempati ruang dan memiliki massa. Segala sesuatu itu bisa sesuatu yang terlihat (zat cair dan zat padat) ataupun yang tidak tampak yaitu zat gas. Maksud materi menempati ruang adalah benda dapat ditempatkan dalam suatu ruang atau wadah tertentu sedangkan materi mempunyai massa, memiliki maksud bahwa benda yang termasuk materi dapat diukur, ditimbang dengan menggunakan alat ukur tertentu yaitu neraca atau timbangan. Memahami konsep energi adalah sesuatu yang kompleks, tidak hanya mempelajari konsep sains semata, dalam hal ini energi, akan tetapi para pebelajar juga harus berpikir bagaimana sumber energi (bahan baku) itu tetap lestari, terjaga dengan baik, maka tentu konsekuensinya adalah harus menjaga dan merawat lingkungan alam sekitar dengan baik pula. Materi pasti mengalami perubahan, baik fisika maupun kimia. Dengan demikian setiap materi mengandung dan terkait dengan energi. Bila materi berubah akan disertai perubahan energinya.
2.1 Sifat Fisika
Sifat fisika merupakan sifat materi yang dapat dilihat secara langsung
dengan indra. Sifat fisika antara lain wujud zat, warna, bau, titik leleh,
titik didih, massa jenis, kekerasan, kelarutan, kekeruhan, dan kekentalan. Kamu
akan mempelajari beberapa sifat fisika tersebut.
1.
Wujud zat
Wujud zat dibedakan atas zat padat, cair, dan gas. Kamu telah mempelajari
sifat-sifat zat padat, cair, dan gas pada Bab III. Untuk mengingat kembali,
coba perhatikan sifat-sifat dari ketiga wujud zat tersebut ada berikut:
No
|
Zat Padat
|
Zat Cair
|
Zat Gas
|
1.
|
Mempunyai bentuk dan
volume tertentu.
|
Bentuk tidak tetap bergantung
wadahnya, volume tertentu.
|
Tidak mempunyai bentuk dan
volume tertentu, bergantung
tempatnya.
|
2.
|
Jarak antarpartikel sangat
rapat
|
Jarak antarpartikel agak renggang.
|
Jarak antarpartikel sangat
renggang.
|
3.
|
Partikel-partikelnya tidak
dapat bergerak bebas
|
Partikel-partikelnya dapat
bergerak bebas.
|
Partikel-partikelnya dapat
bergerak sangat cepat.
|
Padatan memiliki bentuk tetap karena partikel-partikelnya diikat erat
bersama, sering dalam pola teratur yang disebut dengan kisi (lattice). Dalam
suatu cairan, gaya antarpartikel terlalu lemah untuk menahannya dalam formasi
yang tetap sehingga partikel-partikel ini dapat bergeser dengan mudah dan
saling melewati satu sama lain. Energi kinetik partikelpartikel gas cukup
besar. Gas juga memiliki energi kinetic yang cukup untuk menyebar dan memenuhi
seluruh tempat atau wadahnya. Perhatikan susunan partikel-partikel zat padat,
cair dan gas pada gambar berikut.
(a) Susunan partikel
zat padat, (b) zat cair, dan (c) zat gas.
|
2.
Kekeruhan (Turbidity)
Kekeruhan terjadi pada zat cair. Kekeruhan cairan disebabkan adanya
partikel suspensi yang halus. Jika sinar cahaya dilewatkan pada sampel keruh
maka intensitasnya akan berkurang karena dihamburkan. Hal ini bergantung konsentrasinya.
Alat untuk mengetahui intensitas cahaya pada zat cair yang keruh ini atau untuk
mengetahui tingkat kekeruhan disebut turbidimetry.
3.
Kekentalan (Viskositas)
Kekentalan atau viskositas adalah ukuran ketahanan zat cair untuk mengalir.
Untuk mengetahui kekuatan mengalir (flow rate) zat cair digunakan viskometer.
Flow rate digunakan untuk menghitung indeks iskositas. Aliran atau
viskositas suau cairan dibanding dengan aliran air memberikan viskositas
relatif untuk cairan tersebut. Angka pengukuran viskositas relatif cairan
disebut dengan indeks viskositas. Indeks viskositas dapat dirumuskan seperti
berikut.
Angka indeks viskositas suatu cairan di bawah 1 berarti viskositasnya di
bawah viskositas air. Adapun angka indeks viskositas di atas 1 berarti
viskositasnya di atas viskositas air. Viskositas cairan terjadi arena
gesekan antara molekulmolekul. Viskositas sangat dipengaruhi oleh struktur
molekul cairan. Jika struktur molekulnya kecil dan sederhana maka molekul
tersebut dapat bergerak cepat, misalkan air. Jika molekulnya besar dan saling
bertautan maka zat tersebut akan bergerak sangat lambat, misalkan oli.
Molekul-molekul cairan yang bergerak cepat dikatakan memiliki viskositas atau
kekentalan rendah sedangkan molekul cairan yang bergerak lambat dikatakan
memiliki kekentalan tinggi.
4.
Titik Didih
Titik didih merupakan suhu ketika suatu zat mendidih. Mendidih berbeda
dengan menguap. Mendidih terjadi pada suhu tertentu, yaitu pada
titik didih sedangkan menguap terjadi pada suhu berapa saja di awah titik
didih. Misal pada saat kamu menjemur pakaian, maka airnya menguap bukan
mendidih. Titik didih berbagai zat berbeda, bergantung pada struktur dan sifat
bahan. Perhatikan titik didih beberapa zat pada tekanan 1 atm pada berikut.
Titik didih berbagai zat pada tekanan 1 atm.
Titik didih berbagai zat pada tekanan 1 atm.
No
|
Nama Zat
|
Titik Didih (°C)
|
1.
2.
3.
4.
5.
|
Nitrogen
Oksigen
Alkohol (etanol)
Air
Tembaga
|
-196
-183
78
100
2595
|
5. Titik Leleh
Titik leleh merupakan suhu ketika zat padat berubah menjadi zat cair. Misal
garam dapur jika dipanaskan akan meleleh menjadi cairan. Perubahan ini
dipengaruhi oleh struktur kristal zat padat tersebut. Zat cair dan zat gas juga
memiliki titik leleh tetapi perubahannya tidak dapat diamati pada suhu kamar.
Perhatikan titik leleh beberapa zat pada berikut.
Titik leleh berbagai zat pada tekanan 1 atm.
No
|
Nama Zat
|
Titik Didih (°C)
|
1.
2.
3.
4.
5.
6.
|
Nitrogen
Oksigen
Alkohol (etanol)
Air
Tembaga
Besi
|
-210
-216
-117
0
1083
1535
|
6.
Kelarutan
Contoh larutan gula, dan larutan garam. Larutan merupakan campuran
homogen. Dalam larutan terdapat dua komponen yaitu pelarut dan terlarut.
Pelarut merupakan zat yang melarutkan dan biasanya jumlahnya lebih banyak,
sedangkan terlarut merupakan zat yang terlarut, biasanya jumlahnya
lebih kecil. Misal larutan garam, maka zat terlarutnya garam dan pelarutnya
air. Pada umumnya larutan berupa cairan tetapi larutan juga terjadi dalam
bentuk gas dan padat. Contoh larutan gas adalah udara yang terdiri dari
oksigen, nitrogen, karbon dioksida dan gas-gas lain. Contoh larutan padatan
adalah stainless steel. Kelarutan menerangkan tingkat suatu zat saling
melarutkan. Ahli kimia menerangkan kelarutan dengan istilah berupa
banyaknya zat terlarut tertentu yang akan melarut ke dalam larutan tertentu
pada suhu tertentu. Kemampuan melarut bergantung pada gaya tarik partikel zat
terlarut dengan partikel pelarutnya. Misal dalam proses pelarutan garam dalam
air, maka molekul air pertama-tama menarik molekul garam menjauh satu dengan
lain hingga suatu saat tercapai suatu keadaan molekul air tidak mampu
memisahkan molekul garam dari yang lain atau disebut jenuh. Perhatikan gambar
berikut.
a. Molekul-molekul air (H2O), ion Na+ dan ion Cl¯.
b. Molekul-molekul air menarik ion-ion dari kristal.
c. Molekul-molekul air mengelilingi ion-ion dalam larutan.
Butiran garam terdiri atas ion natrium dan klorida yang terikat bersama dalam formasi yang disebut kisi kristal. Air melarutkan garam dengan menarik ion dari kisi kristal dan mengelilinginya. Kelarutan dipengaruhi oleh beberapa faktor, antara lain seperti berikut:
1) Suhu
Perhatikan saat kamu
membuat air kopi. Gula dan kopi akan lebih cepat larut dalam air panas daripada
dalam air dingin. Mengapa demikian? Pada saat melarutkan bentuk padat menjadi
cair melibatkan penghancuran struktur yang kaku, atau kisi-kisi kistal dari zat
padat. Pada peristiwa ini diperlukan energi. Kenaikan suhu menyebabkan energi
kinetik partikel zat bertambah sehingga partikel pada suhu yang tinggi bergerak
lebih cepat dibandingkan pada suhu rendah. Kondisi ini menyebabkan terjadinya
tumbukan antara partikel zat terlarut dengan partikel pelarut.
2) Volume pelarut
Misalkan kamu
melarutkan 2 sendok makan gula dalam 100 mL air dan melarutkan 2 sendok makan
gula dalam 5.000 mL air, manakah yang lebih cepat larut? Gula 2 sendok makan akan
lebih cepat larut dalam 5.000 mL air daripada dalam 100 mL air. Semakin besar
volume pelarut, maka jumlah partikel pelarut akan semakin banyak. Kondisi
tersebut memungkinkan lebih banyak terjadi tumbukan antara partikel zat
terlarut dengan partikel zat pelarut sehingga zat padat umumnya lebih mudah
larut.
3) Ukuran zat terlarut
Misalkan kamu
melarutkan 2 sendok makan gula pasir halus dalam 100 mL air dan 1 sendok makan
gula batu dalam 100 mL air, manakah yang lebih cepat larut? Gula pasir lebih
cepat larut daripada gula batu. Hal ini karena gula pasir halus memiliki ukuran
partikel yang lebih kecil sehingga memiliki permukaan sentuh yang luas
dibandingkan gula batu. Jadi makin kecil ukuran zat terlarut makin besar
kelarutan zat tersebut.
2.2 Sifat Kimia
Sifat kimia merupakan sifat yang dihasilkan dari perubahan kimia, antara
lain mudah terbakar, mudah busuk, dan korosif. Sifat-sifat ini karakteristik.
a.
Mudah terbakar
Pernahkah kamu
menyalakan kembang api? Saat kamu membakar kembang api maka dengan segera akan
terjadi nyala warna-warni yang indah. Pada peristiwa ini terjadi perubahan
kimia. Pada mulanya kembang api dibuat dari campuran antara kalium nitrat
(KNO3) , belerang dan arang kayu. Namun sekarang kembang api telah dibuat
dengan warna-warni, yaitu dari strontium dan litium (warna merah), natrium
(warna kuning), barium (warna hijau), dan tembaga (warna biru). Contoh lain
yang mudah terbakar adalah fosfor. Fosfor dapat terbakar bila kena udara,
membentuk senyawa fosfor oksida. Oleh karena itu fosfor disimpan di dalam air.
Fosfor dimanfaatkan untuk membuat korek api.
b.
Mudah busuk
Jika buah dan sayur
dibiarkan di udara terbuka maka lama kelamaan buah dan sayur tersebut akan
membusuk. Buah dan sayur yang busuk akan menimbulkan bau yang tidak sedap.
Proses pembusukan ini karena adanya mikroorganisme.
c.
Korosif
Perkaratan atau korosi
merupakan peristiwa rusaknya logam oleh pengaruh lingkungan, yaitu adanya
oksigen dan kelembapan. Besi adalah salah satu contoh logam yang mudah
berkarat. Pada proses korosi terbentuk zat yang jenisnya baru yaitu karat.
Gejala yang tampak pada korosi adalah terjadi perubahan warna. Pada umumnya
logam bersifat korosif kecuali emas, platina, dan air raksa.
2.3 Metode-Metode Pemisahan Campuran
Campuran dapat tersusun atas beberapa unsur ataupun senyawa.
Komponen-komponen penyusun suatu campuran tersebut dapat dipisahkan berdasarkan
sifat fisika zat penyusunnya. Contoh campuran antara lain udara, air laut, dan
minyak mentah. Garam dapur yang kamu konsumsi merupakan hasil pemisahan dari
campuran air laut. Hal ini karena air laut sebenarnya tersusun atas air, garam,
dan beberapa mineral. Emas ditemukan sebagai bijih emas yang bercampur dengan
tanah, pasir, dan batuan lain. Oleh karena itu untuk mendapatkan emas murni,
perlu dilakukan pemisahan. Tembaga diperoleh dari pemisahan campuran berbagai
mineral dan senyawa. Senyawanya ditemukan pada beberapa bijih, misalnya pirit
tembaga dan malasit. Metode yang umum dipergunakan untuk memisahkan campuran
antara lain filtrasi, dekantasi, sentrifugasi, evaporasi, distilasi, corong
pisah, kromatografi, sublimasi, ekstraksi, dan daya tarik magnet. Agar lebih
jelas, berikut akan dibahas beberapa metode tersebut.
1.
Penyaringan (Filtrasi)
Filtrasi atau penyaringan adalah teknik penyaringan yang dapat digunakan
untuk memisahkan campuran yang ukuran partikel zat-zat penyusunnya berbeda.
Misalnya, pada pembuatan santan kelapa. Santan kelapa dibuat dengan cara memisahkan
campuran santan, air, dan ampas kelapa dengan menggunakan saringan. Dengan
menggunakan saringan yang berpori-pori kecil, santan kelapa dapat melewati
lubang saringan dan ampas kelapa tertahan dalam saringan. Pernahkah kamu
membuat air teh? Untuk mendapatkan air teh maka kamu perlu merendam teh dalam
air panas, kemudian gunakan saringan untuk memisahkan teh dengan air tehnya.
Nah, agar kamu lebih memahami proses pemisahan dengan cara filtrasi,
lakukanlah kegiatan berikut :
Dapat mengamati butiran-butiran kapur tertahan pada kertas saring (residu).
Adapun air dapat melewatinya (filtrat). Kertas saring memiliki pori-pori yang
sangat kecil sehingga dapat menahan butiran-butiran kapur tersebut. Dasar dari
penyaringan di atas adalah perbedaan ukuran partikel air dengan butiran kapur.
Prinsip penyaringan banyak dimanfaatkan dalam kehidupan sehari-hari. Misalnya,
kamu menggunakan saringan teh agar ampas teh tidak terbawa dalam air teh. Nah,
dapatkah kamu menyebutkan contoh penyaringan lainnya dalam kehidupan
seharihari? Diskusikanlah dengan teman sekelompokmu, kemudian bacakan hasilnya
di depan kelas.
2. Sentrifugasi
a. Darah sebelum disentrifugasi,
b. Darah setelah sentrifugasi.
c. Komponen penyusun darah terpisah setelah disentrifugasi.
|
Suspensi yang
partikel-partikelnya sangat halus tidak bisa dipisahkan dengan cara filtrasi. Partikel-partikelnya
dapat melewati saringan atau bahkan menutupi lubang pori-pori saringan sehingga
cairan tidak dapat lewat. Cara untuk memisahkan suspensi adalah dengan
membiarkannya hingga mengendap. Setelah beberapa saat, partikelpartikelnya
mengendap sehingga cairannya dapat dituang. Akan tetapi banyak partikel
suspense yang terlalu kecil untuk disaring tetapi juga tidak dapat mengendap.
Hal ini karena partikel-partikel padatan tersebut dipengaruhi oleh gerakan
molekul cairan yang sangat cepat. Suspensi yang sulit dipisahkan ini dapat
dipisahkan dengan sentrifugasi. Tabung sebagai wadah suspensi dikunci pada
gagang atau rotor untuk mengitari sebuah alat atau mesin pemutar. Batang
vertikal di tengahnya diputar dengan motor listrik. Batang itu berputar dengan
sangat cepat. Tabung akan mengayun dengan cepat tetapi mulut tabung tetap
menghadap ke tengah. Sentrifugasi yang terkecil dapat memutar dengan kecepatan
2.000 putaran/menit (rpm). Sentrifugasi dapat digunakan untuk memisahkan susu
menjadi susu krim dan susu skim. Sentrifugasi juga dapat digunakan untuk memisahkan
komponenkomponen darah.
3.
Evaporasi (Penguapan)
Pada awal bab telah dijelaskan bahwa garam dapat diperoleh dari air laut
dengan proses penguapan atau evaporasi. Untuk memahami pemisahan campuran dengan proses
penguapan lakukanlah kegiatan berikut.
Pada proses penguapan, larutan dipanaskan sampai zat pelarutnya (air) menguap dan meninggalkan zat terlarut (garam). Proses pemisahan dengan cara penguapan ini dapat terjadi karena zat terlarut (garam) memiliki titik didih yang lebih tinggi daripada zat pelarutnya (air).
4.
Distilasi (Penyulingan)
Distilasi atau penyulingan adalah proses pemisahan campuran dengan
penguapan yang diikuti pengembunan. Mula-mula campuran yang akan dipisahkan
dipanaskan hingga di atas titik didih zat yang akan dipisahkan. Oleh karena zat
yang akan dipisahkan memiliki titik didih yang lebih rendah daripada larutan,
maka zat tersebut akan menguap terlebih dahulu. Uap yang terbentuk kemudian
didinginkan sehingga menjadi cairan. Cairan yang dihasilkan selanjutnya
ditampung dalam suatu wadah sebagai distilat.
Prinsip penyulingan digunakan di industri minyak untuk memisahkan bensin,
minyak tanah, dan solar dari minyak mentah. Hal ini dapat dilakukan karena
komponen-komponen minyak bumi mempunyai titik didih yang berbeda-beda. Oleh
karena dalam campuran (minyak mentah) terdapat lebih dari satu komponen yang
akan dipisahkan maka harus dilakukan distilasi bertingkat atau biasa disebut
distilasi fraksionasi.
5. Sublimasi
Sublimasi adalah proses pemisahan campuran yang dapat digunakan untuk
memisahkan komponen yang dapat menyublim dari campurannya yang tidak dapat
menyublim. Masih ingatkah kamu zat yang dapat menyublim jika dipanaskan? Kapur
barus merupakan zat yang dapat menyublim jika dipanaskan. Nah, jika kapur barus
ini bercampur dengan zat pengotor seperti pasir, untuk memisahkan kapur barus
dengan zat pengotor dapat dilakukan dengan proses sublimasi. Ketika campuran
kapur barus dan pasir dipanaskan, kapur barus akan menguap sedangkan pasir tidak.
Uap kapur barus akan segera mengkristal ketika menemui daerah yang cukup
dingin. Dengan demikian kapur barus murni dapat diperoleh kembali. Nah,
dapatkah kamu menyebutkan contoh proses pemisahan campuran dengan cara
sublimasi? Proses sublimasi dapat juga digunakan untuk memisahkan iodin dari
zat pengotornya.
2.4 Proses Pengolahan Air
Berapa banyak air yang kamu buang dalam sehari? Tentu tak terhitung
jumlahnya. Padahal, saat ini krisis air bersih mulai melanda negara kita. Hal
ini disebabkan penjarahan hutan secara besar-besaran sehingga menyebabkan
turunnya debit air bersih yang mengalir ke sungai. Dalam kondisi seperti itu,
pencemaran air semakin hebat yang diakibatkan limbah rumah tangga dan industri.
Jika kamu mengamati sungai-sungai di sekelilingmu, hanya sedikit sungai yang
masih mengalirkan air bersih. Umumnya sungai mengalirkan air kotor berwarna
kecokelatan. Beban lingkungan yang semakin berat akibat pencemaran air dan
udara membuat kualitas air semakin buruk. Namun, di sisi lain, kebutuhan
masyarakat akan air semakin meningkat akibat peningkatan jumlah penduduk.
Fenomena tersebut tentunya memerlukan konsep pengelolaan sumber daya air yang
terpadu dengan mempertimbangkan keseimbangan air. Air pada dasarnya merupakan
sumber daya alam yang dapat diperbaharui dan merupakan sumber daya yang sangat
penting dalam kehidupan makhluk hidup di dunia ini. Air minum harus memenuhi
persyaratan-persyaratan dari segi fisik, kimia, maupun biologi.
1.
Kualitas dari segi
fisik yaitu tidak berwarna, tidak berbau, jernih, dan tidak berasa.
2.
Kualitas dari segi
kimia yaitu air tidak mengandung zat-zat kimia yang beracun dan bebas dari
garam-garam mineral.
Di negara kita, pengolahan air bersih dilakukan oleh PDAM. Tahukah kamu
bahwa sumber air leding dari PDAM yang bersih dan bening sebenarnya berasal
dari air sungai yang berwarna cokelat, kotor, dan berbau? Perhatikan proses
pengolahan air pada gambar di atas. Mula-mula, air dari sungai, danau, atau air
tanah dipompakan ke dalam bak prasedimentasi. Pada tahap ini dilakukan
penyimpanan air dan mengendapkan lumpur atau padatan yang terbawa. Setelah itu,
air dialirkan ke dalam bak penyaring untuk memisahkan lumpur yang lebih halus
dan zat pengotor yang lebih kecil. Air bersih yang diperoleh dari hasil
saringan, selanjutnya diberi kaporit (senyawa kimia yang mengandung klorin)
untuk membunuh bakteri penyebab penyakit. Air yang telah memenuhi standar
bersih, kemudian dialirkan ke dalam bak penampungan untuk disalurkan ke
pemukiman, kantorkantor, dan pabrik (konsumen). Lakukan kegiatan berikut untuk
mendapatkan air bersih dengan cara sederhana.
Bagaimana usaha yang dapat dilakukan untuk mendapatkan air bersih? Di negara
kita, pengolahan air bersih dilakukan oleh PDAM. Tahukah kamu bahwa sumber air
leding dari PDAM yang bersih dan bening sebenarnya berasal dari air sungai yang
berwarna cokelat, kotor, dan berbau? Perhatikan proses pengolahan air pada
Gambar di atas. Mula-mula, air dari sungai, danau, atau air tanah dipompakan ke
dalam bak prasedimentasi. Pada tahap ini dilakukan penyimpanan air dan
mengendapkan lumpur atau padatan yang terbawa. Setelah itu, air dialirkan ke
dalam bak penyaring untuk memisahkan lumpur yang lebih halus dan zat pengotor
yang lebih kecil. Air bersih yang diperoleh dari hasil saringan, selanjutnya
diberi kaporit (senyawa kimia yang mengandung klorin) untuk membunuh bakteri
penyebab penyakit. Air yang telah memenuhi standar bersih, kemudian dialirkan
ke dalam bak penampungan untuk disalurkan ke pemukiman, kantorkantor, dan
pabrik (konsumen). Lakukan kegiatan berikut untuk mendapatkan air bersih dengan
cara sederhana.
Banyak zat yang menyebabkan air menjadi tidak jernih atau keruh. Oleh karena
itu perlu dilakukan penjernihan air, karena kejernihan termasuk salah satu
standar kualitas fisik air minum. Berikut ini cara sederhana untuk menjernihkan
air.
1.
Pengendapan
Pengendapan dapat dilakukan dengan mengendapkan air dalam bak penampungan yang bersih dan bila kotor dikuras.
Pengendapan dapat dilakukan dengan mengendapkan air dalam bak penampungan yang bersih dan bila kotor dikuras.
2.
Penyaringan/filtrasi
Air yang terlalu keruh karena adanya partikel tertentu tidak dapat dijernihkan hanya dengan pengendapan, tetapi perlu penyaringan. Penyaringan dilakukan secara bertahap dengan melalui saringan pasir halus, pasir kasar, dan batu gamping. Air mula-mula dilewatkan dalam pasir halus kemudian dilewatkan pasir kasar dan selanjutnya dalam batu gamping, sehingga akan didapatkan air yang lebih jernih dan bersih.
Air yang terlalu keruh karena adanya partikel tertentu tidak dapat dijernihkan hanya dengan pengendapan, tetapi perlu penyaringan. Penyaringan dilakukan secara bertahap dengan melalui saringan pasir halus, pasir kasar, dan batu gamping. Air mula-mula dilewatkan dalam pasir halus kemudian dilewatkan pasir kasar dan selanjutnya dalam batu gamping, sehingga akan didapatkan air yang lebih jernih dan bersih.
3.
Koagulasi
Terkadang ditemukan air masih keruh meskipun sudah dilakukan pengendapan dan penyaringan. Hal ini karena ukuran partikel penyebab keruh sangat kecil atau seukuran partikel koloid sehingga tidak dapat mengendap. Untuk mengendapkan partikel ini maka ditambahkan zat kimia yang berfungsi sebagai pengendap atau koagulan misalnya tawas atau aluminium sulfat (Al2(SO4)3⋅ 18 H2O)
Terkadang ditemukan air masih keruh meskipun sudah dilakukan pengendapan dan penyaringan. Hal ini karena ukuran partikel penyebab keruh sangat kecil atau seukuran partikel koloid sehingga tidak dapat mengendap. Untuk mengendapkan partikel ini maka ditambahkan zat kimia yang berfungsi sebagai pengendap atau koagulan misalnya tawas atau aluminium sulfat (Al2(SO4)3⋅ 18 H2O)
2.5 Perubahan Materi
Perubahan materi merupakan kajian yang cukup penting di dalam ilmu kimia. Perubahan
dapat diketahui dari perbedaan keadaan awal dan keadaan akhir materi setelah
mengalami perubahan. Keadaan yang dimaksud meliputi sifat-sifat maupun
strukturnya. Materi dapat dikenali berdasarkan sifat-sifat fisika maupun
sifat-sifat kimianya. Yang termasuk sifat-sifat fisika antara lain wujud,
warna, titik leleh, titik didih, dan kelarutan. Sifat-sifat kimia materi
didasarkan pada kemampuannya dalam melakukan perubahan atau reaksi kimia.
Misalnya, bensin lebih mudah terbakar daripada minyak tanah. Sehubungan dengan
hal tersebut terdapat dua jenis perubahan materi, yaitu perubahan fisika dan
perubahan kimia. Hal yang perlu digarisbawahi adalah perubahan fisika dapat
menghasilkan perubahan wujud materi, tetapi tidak menghasilkan materi baru.
Adapun perubahan kimia, menghasilkan materi baru. Nah, agar kamu lebih memahami
perubahan fisika dan perubahan kimia pelajarila uraian berikut dengan
baik.
1.
Pengertian Perubahan
Materi
Pada kehidupan
sehari-hari kamu selalu melihat peristiwa perubahan materi, baik secara alami
maupun dengan disengaja. Peristiwa perubahan materi secara alami, misalnya
peristiwa pembusukan makanan atau perkaratan besi. Peristiwa perubahan materi
dengan disengaja, misalnya kertas yang dibakar atau lilin yang dibakar.
Perubahan Fisika
Kita telah mengetahui bahwa es yang mencair tidak menghasilkan zat yang
baru. Es dan air tersusun atas senyawa yang sama, yaitu H2O. Perbedaan antara
es dan air hanya terlihat dari wujudnya saja. Es merupakan air yang berwujud
zat padat, sedangkan air berwujud zat cair. Dapatkah kamu menyebutkan contoh
perubahan fisika lainnya? Pada Gambar 4.10 kamu dapat mengamati proses
peleburan besi. Batang besi yang dipanaskan dengan suhu tinggi akan berubah
menjadi besi cair. Cairan besi yang sudah meleleh itu dimasukkan dalam cetakan.
Setelah itu, dibiarkan menjadi dingin hingga terbentuk padat kembali.
Pada proses peleburan besi, antara besi sebelum dileburkan dengan besi
yang sudah menjadi cair masih memiliki sifat yang sama atau hanya mengalami
perubahan wujud saja. Perubahan materi pada besi yang dileburkan dapat
dikatakan sebagai perubahan fisika. Pada perubahan fisika memungkinkan kita
mendapatkan kembali materi semula.
Perubahan Kimia
Kayu yang dibakar
merupakan
contoh perubahan kimia. |
Perubahan Fisika
|
Perubahan Kimia
|
• Tidak terbentuk zat
yang jenisnya baru.
• Reversibel.
• Tidak terjadi reaksi kimia.
|
• Terbentuk zat yang
jenis-nya baru.
• Irreversibel.
• Terjadi reaksi
kimia, ditandai dengan pembentukan gas, endapan, warna, dan perubahan energi.
|
2.
Manfaat Perubahan
Materi
Perubahan fisika berperan penting dalam industri obatobatan atau farmasi,
yaitu dalam proses ekstrasi zat-zat aktif yang terkandung dalam bahan alam.
Zat-zat aktif ini berguna untuk bahan baku obat. Senyawa yang terkandung dalam
dedaunan atau akar-akaran dikeluarkan menggunakan pelarut tertentu dalam alat
khusus. Menyeduh kopi dengan air panas, merupakan ekstraksi kafein dari kopi
agar larut dalam air. Kafein bersifat larut dalam air panas. Seperti halnya
perubahan fisika, perubahan kimia pun banyak manfaatnya. Hampir semua industri
yang memproduksi bahan baku menggunakan prinsip-prinsip perubahan kimia atau
reaksi kimia. Dalam industri plastik, zat-zat organik yang bersumber dari gas
alam dan minyak bumi diubah melalui reaksi dan proses kimia menjadi plastik,
misalnya polietilen (PE), polipropilen (PP), dan polivinilklorida (PVC). Hampir
semua industri, mulai dari yang berteknologi sederhana (misalnya industri tahu)
hingga yang berteknologi tinggi (misalnya pembuatan pesawat terbang) menerapkan
prinsip-prinsip perubahan fisika dan perubahan kimia. Perubahan kimia dan
perubahan fisika terkadang terjadi secara bersamaan, misalnya pada pembakaran
lilin. Lilin terbakar menghasilkan nyala dan asap hitam (karbon). Hal ini
menunjukkan terjadinya reaksi kimia. Di sisi lain, terjadi pula perubahan
fisika yaitu lilin meleleh menjadi cair.
2.6 Reaksi Kimia
Apakah yang dimaksud dengan reaksi kimia? Reaksi kimia adalah peristiwa
perubahan kimia dari zat-zat yang bereaksi (reaktan) menjadi zat-zat hasil
reaksi (produk). Pada reaksi kimia selalu dihasilkan zat-zat yang baru dengan
sifat-sifat yang baru. Reaksi kimia dituliskan dengan menggunakan lambang
unsur. Marilah kita lihat bagaimana cara menyatakan suatu reaksi dengan
menggunakan lambang. Perhatikan reaksi merkuri oksida yang menghasilkan merkuri
dan oksigen berikut.
HgO → Hg + O2
Ahli kimia akan menerjemahkan lambang-lambang di atas sebagai berikut.
“Molekul HgO yang terdiri dari satu atom merkuri (Hg) ditambah satu atom
oksigen (O), menghasilkan (→) satu molekul yang terdiri dari satu atom merkuri
(Hg) ditambah satu molekul yang terdiri dari dua atom oksigen (O2)”.Gabungan
lambang yang menunjukkan suatu reaksi kimia dinamakan persamaan kimia. Zat yang
bereaksi di sebelah kiri anak panah disebut pereaksi. Sedangkan zat di sebelah
kanan anak panah disebut hasil reaksi. Jadi, HgO pada persamaan kimia di atas
adalah pereaksi. Hg dan O2 adalah hasil reaksi. Hukum konservasi materi
menyatakan bahwa dalam reaksi kimia biasa tidak ada materi yang hilang meskipun
mungkin berubah. Jumlah atom dalam pereaksi harus tetap sama dengan yang
dihasilkan, betapa pun atom-atom itu berubah untuk membentuk pola molekul yang
baru. Apabila suatu persamaan memenuhi syarat-syarat itu, dapat dikatakan
persamaan itu setimbang. Bagaimana dengan persamaan HgO → Hg + O2?
Untuk mengimbangkan persamaan, kita tambahkan angka 2 sebelum HgO dan angka 2
lagi sebelum Hg. 2HgO berarti dua molekul yang masing-masing terdiri dari satu
atom merkuri dan satu atom oksigen. Persamaan itu sekarang menjadi:
2 HgO → 2 Hg + O2
Dengan kata lain, dua molekul merkuri oksida (HgO) yang masing-masing terdiri dari satu atom merkuri dan satu atom oksigen menghasilkan dua molekul merkuri yang masingmasing terdiri dari satu atom merkuri ditambah satu molekul oksigen, yang terdiri dari dua atom oksigen. Persamaan ini sekarang telah setimbang, di sebelah kiri ada dua atom merkuri dan dua atom oksigen, demikian juga di sebelah kanan. Perhatikan bahwa dalam hasil reaksi ditulis 2 Hg, bukan Hg2. Hal ini karena molekul merkuri hanya terdiri dari satu atom merkuri. Kalau angka 2 kita tuliskan di bawah, berarti kita mengatakan bahwa molekul itu mengandung dua atom dan ini keliru. Ingat bahwa dalam menyeimbangkan persamaan kita tidak boleh mengganti molekul. Kita hanya boleh mengubah jumlah molekul.
1. Ciri-Ciri Reaksi Kimia
Ketika terjadi reaksi kimia, terdapat perubahan-perubahan yang dapat kita
amati. Perhatikan ciri-ciri reaksi kimia berikut.
b.
Reaksi
Kimia dapat Membentuk Endapan
- Materi didefinisikan segala sesutu yang mempunyai massa, menempati ruang, dan memiliki sifat seperti dapat dilihat, dicium,diraba, didengar atau dirasa.
- Sifat fisika materi meliputi: wujud, rasa bau, warna, bentuk dan tetapan fisika.
- Sifat kimia materi meliputi: kereaktifan (kemudahan bereaksi; mudah terbakar), rumus kimia, struktur ikatan.
- Perubahan fisika merupakan perubahan yang hanya melibatkan perubahan sifat fisika materi, berifat sementara dan tidak menghasilkan zat baru.
- Perubahan kimia merupakan perubahan materi yang melibatkan pada sifat fisika maupun sifat kimia materi, perubahan yang menghasilkan zat baru yang sifatnya kekal.
- Materi yang ada di alam dapat diklasifikasikan menjadi unsur, senyawa dan campuran
- Unsur adalah zat tunggal yang tidak dapat diuraikan lagi menjadi zat yang lebih sederhana dengan reaksi kimia biasa.
- Senyawa adalah zat tunggal yang dapat diuraikan secara kimia menjadi zat yang lebih sederhana yang berbeda sifatnya dengan zat asal.
- Campuran adalah gabungan dari dua atau lebih zat dengan komposisi yang tidak tetap dan sifat zat yang bergabung tidak berubah.
- Campuran ada dua bentuk: Campuran homogen yaitu campuran yang serba sama sedangkan campuran heterogen adalah campuran yang serbaneka.
- Kadar zat menyatakan banyaknya zat itu dalam sejumlah campurannya.
- Kadar zat dapat dinyatakan dalam satuan persen dan bpj
LATIHAN SOAL
- Apa yang dimaksud dengan materi/zat ?
- Mengapa materi dapat berubah dari wujud yang satu ke wujud yang lainnya?
- Sebutkan 5 macam perubahan wujud beserta contohnya!
- Apa bedanya sifat fisika dan sifat kimia?
- Apa bedanya perubahan kimia dengan perubahan fisika? Berikan masing-masing 2 contoh!
- Mengapa materi dapat mengalami perubahan kimia? Jelaskan!












Tidak ada komentar:
Posting Komentar